m (Hayat a déplacé la page Le marteau en règle ! vers Marteau en règle !) |
|||
| Ligne 1 : | Ligne 1 : | ||
{{Tuto Details | {{Tuto Details | ||
| − | |||
|Licences=Attribution (CC-BY) | |Licences=Attribution (CC-BY) | ||
| − | |Description= | + | |Description=Le sable peut être source d'innovation non? |
| − | |Disciplines scientifiques= | + | |Disciplines scientifiques=Earth Sciences, Life Sciences, Matter Sciences, Physics |
| − | |Difficulty= | + | |Difficulty=Expert |
| − | |Duration= | + | |Duration=2-3 |
| − | |Duration-type= | + | |Duration-type=hour(s) |
| − | |||
}} | }} | ||
{{Introduction}} | {{Introduction}} | ||
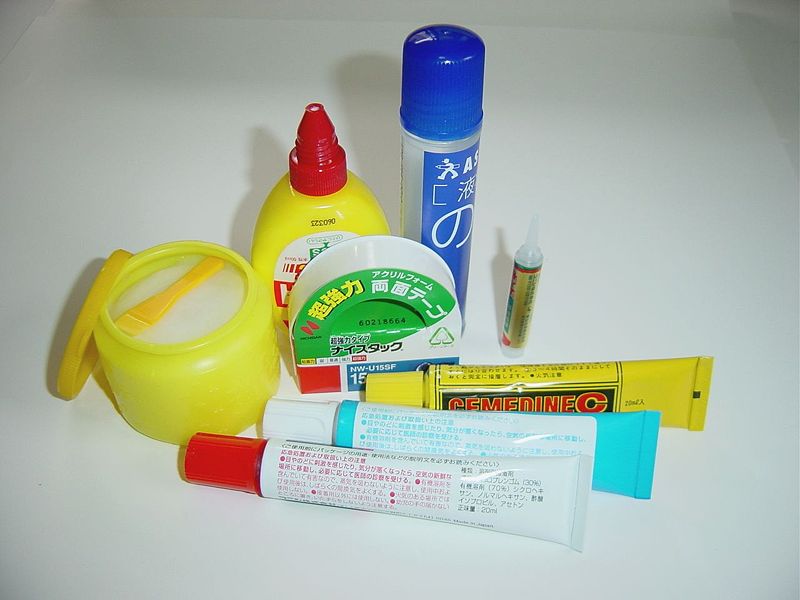
{{Materials | {{Materials | ||
|ItemList={{ItemList | |ItemList={{ItemList | ||
| − | |Item= | + | |Item=Marteau |
}}{{ItemList | }}{{ItemList | ||
| − | |Item= | + | |Item=Règle |
}}{{ItemList | }}{{ItemList | ||
| − | |Item= | + | |Item=Compas |
}}{{ItemList | }}{{ItemList | ||
| − | |Item= | + | |Item=Bassine |
| − | }} | + | }}{{ItemList |
| − | }} | + | |Item=Clou |
| − | {{ | + | }}{{ItemList |
| − | | | + | |Item=Colle |
| − | | | + | }}{{ItemList |
| − | }} | + | |Item=Ciseaux |
| − | {{ | + | }}{{ItemList |
| − | | | + | |Item=Carton |
| − | | | + | }}{{ItemList |
| − | | | + | |Item=Feuille papier 80g |
| − | | | + | }}{{ItemList |
| + | |Item=Boite de conserve | ||
| + | }}{{ItemList | ||
| + | |Item=Feutre de couleur | ||
| + | }}{{ItemList | ||
| + | |Item=Rapporteur | ||
}} | }} | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | | | + | |Step_Content=# Pour créer la base de mesure de l'angle : |
| − | |||
| − | + | Il faut découper un cercle de diamètre 19 cm sur la feuille de carton, puis couper ce cercle en deux et en garder la moitié. Sur la feuille de papier A4 en format paysage, tracer une ligne horizontale de 19 cm avec le feutre noir à environ un tiers du bas de la feuille. Tracer ensuite avec le feutre les différents angles (compris entre 20° et 50°) en partant de chaque extrémité de la ligne, comme indiqué sur le schéma ci-dessous. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | Dans le carton, découper un rectangle de la même largeur que le petit côté du pavé et de longueur 20 cm. Coller la feuille de mesure des angles sur la moitié de ce rectangle, comme pour faire une sorte de panneau. Clouer le demi-cercle sur une des surfaces carrées du pavé, puis clouer l'ensemble feuille rectangle sur une des surfaces rectangulaires du pavé, pour faire en sorte que le diamètre du demi-cercle se retrouve contre la ligne tracée sur la feuille A4 (cf. vidéo). | |
| − | + | # Pour mesurer l'angle de chute : | |
| − | |||
| − | + | Jeter du sable sur le demi cercle et regarder l'angle maximal du tas obtenu. | |
| − | |||
| − | + | # Pour créer des formes : | |
| − | + | * Jeter rapidement beaucoup de sable sur la surface carrée du pavé pour obtenir une pyramide carrée. | |
| + | * Jeter rapidement beaucoup de sable sur la surface rectangulaire du pavé pour obtenir une pyramide à base rectangulaire. | ||
| + | * Jeter rapidement beaucoup de sable sur le prisme triangulaire pour obtenir un tétraèdre. | ||
| + | * Jeter rapidement beaucoup de sable sur le cylindre plein pour obtenir un cône. | ||
| − | + | <br /> | |
| − | + | }} | |
| − | + | {{Notes | |
| − | | | + | |Observations=On constate que l'angle de chute du sable est compris entre 30° et 40°. Cela est valable pour toutes les formes obtenues. |
| − | + | |Explanations=Une des propriétés du sable est qu'il forme naturellement des pentes stables jusqu'à environ 40°. Au-delà de cet angle, il s'écoule par avalanches successives pour retrouver cette pente stable. Ce qui explique les pentes mesurées lors de l'expérience. | |
| − | + | |Deepen=Pour obtenir un château de sable, il faut mouiller le sable afin de modifier ses propriétés physiques et ainsi empêcher un écoulement du sable. Plus précisément, l'humidité est essentielle car elle permet la cohésion des grains de sable entre eux. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
}} | }} | ||
{{Tuto Status | {{Tuto Status | ||
| − | |Complete= | + | |Complete=Draft |
}} | }} | ||
| − | |||
Version du 19 mars 2020 à 18:56
- Matériel et outils
La bassine est un accessoire ménager très prisé dans les pays en voie de développement, où elle trouve de multiples usages, principalement alimentaire et pour le linge. Elle sert ainsi de récipient pour collecter et nettoyer de la nourriture (coquillages, légumes, etc.) ; elle permet de transporter le linge sale entre le domicile et le lavoir, avant de le ramener pour le faire sécher.
Le principal lieu de production des bassines est l'Asie du sud-est.L'usage du rapporteur est parfois remplacé par l'usage d'un demi-carré.
Le rapporteur trigonométrique est un instrument de mesure matérialisant le cercle trigonométrique et fournissant une correspondance degrés-radians.
Un théodolite n'est rien d'autre qu'un ensemble de deux rapporteurs (horizontal et vertical) de haute précisionÉtape 1 -
- Pour créer la base de mesure de l'angle :
Il faut découper un cercle de diamètre 19 cm sur la feuille de carton, puis couper ce cercle en deux et en garder la moitié. Sur la feuille de papier A4 en format paysage, tracer une ligne horizontale de 19 cm avec le feutre noir à environ un tiers du bas de la feuille. Tracer ensuite avec le feutre les différents angles (compris entre 20° et 50°) en partant de chaque extrémité de la ligne, comme indiqué sur le schéma ci-dessous.
Dans le carton, découper un rectangle de la même largeur que le petit côté du pavé et de longueur 20 cm. Coller la feuille de mesure des angles sur la moitié de ce rectangle, comme pour faire une sorte de panneau. Clouer le demi-cercle sur une des surfaces carrées du pavé, puis clouer l'ensemble feuille rectangle sur une des surfaces rectangulaires du pavé, pour faire en sorte que le diamètre du demi-cercle se retrouve contre la ligne tracée sur la feuille A4 (cf. vidéo).
- Pour mesurer l'angle de chute :
Jeter du sable sur le demi cercle et regarder l'angle maximal du tas obtenu.
- Pour créer des formes :
- Jeter rapidement beaucoup de sable sur la surface carrée du pavé pour obtenir une pyramide carrée.
- Jeter rapidement beaucoup de sable sur la surface rectangulaire du pavé pour obtenir une pyramide à base rectangulaire.
- Jeter rapidement beaucoup de sable sur le prisme triangulaire pour obtenir un tétraèdre.
- Jeter rapidement beaucoup de sable sur le cylindre plein pour obtenir un cône.
Comment ça marche ?
Observations : que voit-on ?
On constate que l'angle de chute du sable est compris entre 30° et 40°. Cela est valable pour toutes les formes obtenues.
Explications
Une des propriétés du sable est qu'il forme naturellement des pentes stables jusqu'à environ 40°. Au-delà de cet angle, il s'écoule par avalanches successives pour retrouver cette pente stable. Ce qui explique les pentes mesurées lors de l'expérience.
Plus d'explications
Pour obtenir un château de sable, il faut mouiller le sable afin de modifier ses propriétés physiques et ainsi empêcher un écoulement du sable. Plus précisément, l'humidité est essentielle car elle permet la cohésion des grains de sable entre eux.
Dernière modification 2/04/2020 par user:Hayat.
Draft